Le principali cardiopatie valvolari (VHD), le cardiopatie reumatiche, colpiscono circa 41 milioni di persone in tutto il mondo. Tali problemi possono ridurre la qualità della vita, l'aspettativa di vita, la funzionalità fisica e talvolta causare morte improvvisa.
L'attuale intervento clinico gold standard per le VHD è la sostituzione della valvola malata con valvole meccaniche o bioprotesiche. Tuttavia, queste opzioni sono accompagnate da gravi complicazioni come la formazione di coaguli di sangue, calcificazioni, gravi infiammazioni, durata limitata, necessità di terapia anticoagulante per tutta la vita e nessuna crescita del tessuto somatico nel tempo.
I recenti progressi nella stampa 3D, che utilizza biomateriali, biomolecole e/o cellule, hanno dato agli scienziati una capacità senza precedenti per lo sviluppo di costrutti di ingegneria tissutale con geometrie 3D complesse, tra cui le valvole cardiache.

I bioinchiostri per la stampa delle valvole sono stati formulati con polimeri sintetici e naturali, quali poli(alcol vinilico) (PVA), gelatina e κ-carragenina. Il PVA è un materiale solubile in acqua, biocompatibile, biodegradabile e con interessanti proprietà meccaniche. Inoltre, può essere reticolato fisicamente e creare criogel attraverso fasi cicliche di congelamento-scongelamento, dunque, elimina l'uso di potenziali agenti reticolanti chimici citotossici. La gelatina è un polipeptide ampiamente utilizzato nello sviluppo di scaffold di ingegneria tissutale per promuovere la bioattività, la biocompatibilità e il bioriassorbimento. Infine, la κ-carragenina è un polisaccaride in grado di produrre idrogel termosensibili attraverso la formazione dell'elica. I suoi gruppi funzionali, compresi i gruppi solfato e ossidrile, potrebbero anche migliorare le interazioni e il legame tra questi tre composti, rendendola un promettente modificatore reologico per scopi di stampa 3D.
Sono state studiate varie composizioni per trovare gli inchiostri stampabili. Inoltre, sono state valutate le proprietà fisico-chimiche, strutturali, meccaniche, reologiche e biologiche complete dei costrutti sviluppati.
Le proprietà meccaniche hanno riportato risultati paragonabili a quelli dei lembi valvolari nativi: gli idrogel sono in grado di resistere a compressioni cicliche con frequenze simili a quelle di un cuore nativo (circa 1 Hz). Dal punto di vista biologico, gli scaffold compositi hanno rivelato un'elevata biocompatibilità valutata mediante coltura cellulare in vitro utilizzando cellule valvolari abitanti (VIC). Dal punto di vista strutturale, le VIC hanno mostrato il fenotipo fibroblastico atteso con morfologia adeguata. Le valutazioni di emocompatibilità in vitro hanno riportato un'emolisi minima degli idrogel proposti con bassa trombogenicità. Inoltre, l'impianto sottocutaneo ha dimostrato che gli idrogel fabbricati hanno indotto una risposta infiammatoria non cronica e sono stati sottoposti a riassorbimento e rimodellamento in vivo, riconfermandone la biocompatibilità in condizioni fisiologiche.
Dai test eseguiti sulla stampabilità, è risultato che l’inchiostro P10/G2.5/C2.5 risulta essere quello con le più adeguate proprietà reologiche e più adatto alla stampa, dunque, è stato selezionato per la stampa 3D di una valvola cardiaca tricuspide senza la necessità di strutture o bagni di supporto.
La valutazione della stampabilità e la stampa delle valvole cardiache sono state eseguite utilizzando una bioprinter BIO X6 (CELLINK, USA). A tale scopo, gli inchiostri sono stati caricati in cartucce da 3 mL dotate di aghi smussati da 25G e raffreddati a 25 °C prima dell'estrusione. La stampa è stata eseguita a 25 °C con un ugello ad ago smussato da 25G, velocità di movimento dell'ugello di 5 mm s−1, densità di riempimento del 25% con motivo di riempimento rettilineo e temperatura del piano di stampa impostata a 4 °C.
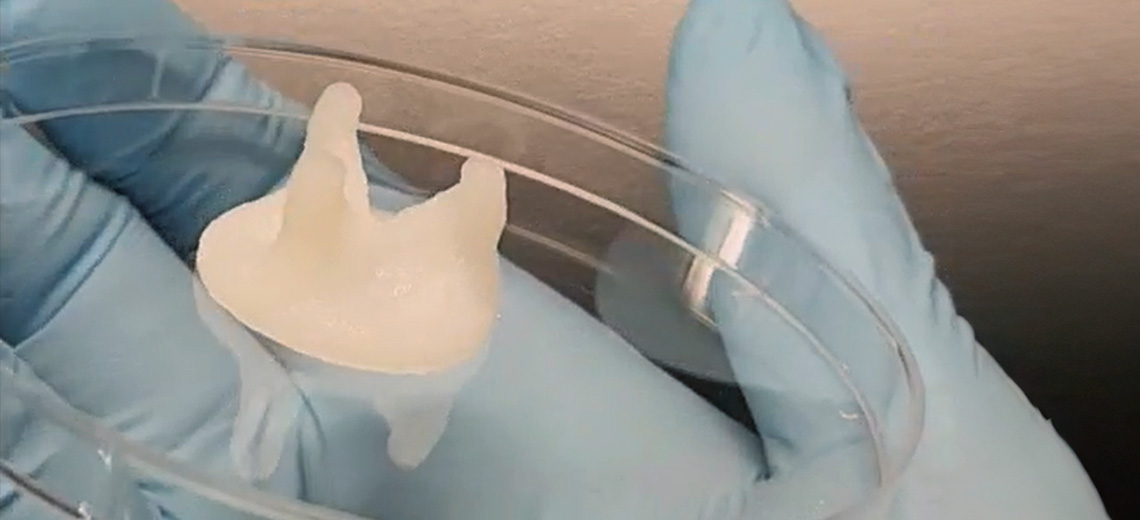
Sono state stampate valvole cardiache di 25 e 13 mm di diametro e i costrutti stampati hanno mostrato una corretta stampa dei lembi valvolari e del seno di Valsalva, confermando la possibilità di stampare valvole cardiache che presentano caratteristiche e dettagli osservati nel tessuto nativo.

Inoltre, sono state stampate valvole protesiche con un diametro di 27 mm, che è vicino alle dimensioni di una valvola nativa. Dopo la reticolazione con i cicli di congelamento-scongelamento, le valvole erano facili da manipolare e tenere con una mano e i lembi risultavano adeguatamente flessibili.

La valutazione preliminare della funzione e dell'integrità delle valvole cardiache stampate in 3D in condizioni fisiologiche è stata eseguita utilizzando un sistema di duplicazione di impulsi su misura.
La valvola tricuspide di dimensioni pediatriche stampata in 3D è stata testata con una frequenza di 90 BPM (condizione pediatrica). I lembi della valvola si sono aperti e chiusi correttamente, con coaptazione completa dei lembi durante ogni ciclo. Nella sistole, la pressione aumenta nel ventricolo sinistro e supera la pressione aortica, portando all'apertura dei lembi valvolari e all'espulsione del fluido. Successivamente, quando le pressioni aortiche diventano superiori al lato ventricolare, durante la diastole, la valvola aortica si chiude. L'area massima di apertura è stata calcolata al ≈16%. Il gradiente di pressione transvalvolare picco-picco di 31 mmHg, estratto dalle forme d'onda di pressione registrate, suggerisce un lieve comportamento stenotico della valvola aortica. Ciò potrebbe essere attribuito alla mancata corrispondenza tra la dimensione della valvola e il modello dell'aorta o alla progettazione digitale della valvola.

La valvola bioprotesica più grande (27 mm di diametro) è stata testata utilizzando una frequenza di 70 BPM per simulare le condizioni fisiologiche dell'adulto. Essa ha dimostrato un'apertura appropriata durante la sistole e una chiusura completa durante la diastole, con un'area di apertura massima più ampia del ≈33%, con un gradiente di pressione transvalvolare picco-picco inferiore a 13 mmHg.

Dunque, la stampa 3D di valvole cardiache fedeli alla struttura di quelle native ha ottenuto un risultato più che discreto. I passi futuri consisteranno nel migliorarne i progetti CAD, nella stampa di nuove valvole e nello studiare in modo completo l'efficienza delle valvole fabbricate in vitro sotto flussi pulsatili fisiologicamente rilevanti. In definitiva, le valvole dovrebbero essere impiantate come sostituto in un modello animale per valutarne la funzionalità in vivo.
Queste tecnologie si proporranno di offrire soluzioni personalizzate e durature per i pazienti affetti da malattie cardiache, aprendo la strada a un futuro in cui le cure mediche sono sempre più adattate alle esigenze individuali e alla salute del paziente.
Fonte: Wiley online library